In der ersten Ausgabe dieser Artikelserie zum Thema MHK (Minimale Hemmkonzentration) haben wir uns mit der Frage beschäftigt, was eine “echte” MHK ist. Wir konnten zeigen, dass es sich bei kommerziellen, automatisierten ID/AST-Systemen in der Regel nicht um die Referenzmethode per se der International Organization for Standardization (ISO) 20776-1:2006 (E)1 bzw. dem Clinical and Laboratory Standards Institute (CLSI) M07-A10 handelt, sondern um sogenannte abgeleitete Verfahren.
Hersteller automatisierter Systeme sind daher verpflichtet, in klinischen Studien die Gleichwertigkeit ihrer Systeme im Vergleich zur Referenzmethode nachzuweisen. Diese Daten bilden den Nachweis dafür, dass die generierten MHK-Werte “echt” sind. In diesem Beitrag werden wir die Art der von VITEK® 2 gesammelten Rohdaten beschreiben und wie diese Rohdaten in einen präzisen MHK-Wert umgewandelt werden.
Wie wird das Keimwachstum gemessen?
Patienten-Isolate werden mittels einer einzeln verpackten VITEK® 2 AST Einweg-Testkarte in einem in sich geschlossenen System analysiert (Abb. 1). Jede Karte enthält als Positivkontrolle mindestens ein Well mit Kulturmedium ohne Antibiotikum (nur wachstumsfördernde Bouillon) sowie mehrere Wells mit Kulturmedium plus verschiedene Antibiotika in ansteigender Konzentration.
VITEK® 2 misst kontinuierlich das Wachstum in allen Wells. Das Wachstum in der Positivkontrolle wird gemessen, bis durch Trübungsmessung eine festgelegte minimale bakterielle Wachstumsrate ermittelt ist (d. h. die prozentuale Veränderung der Messeinheiten für die Lichtdurchlässigkeit – %ΔRTU, raw transmittance units). Ein Wachstum der Positivkontrolle zeigt, ob das Testisolat lebensfähig ist und ein angemessenes Wachstum zeigt, um mit der Analyse der verschiedenen Wells, die Wirkstoffe enthalten, zu beginnen. Diese Analyse erfolgt alle 15 Minuten bis die Empfindlichkeitsprüfung abgeschlossen ist.
Wie Abb. 2 zeigt, wird das Keimwachstum sowohl in der positiven Kontrollkavität als auch in der Antibiotika enthaltenden Kavität gemessen.
Das relative Keimwachstum in jeder Antibiotika enthaltenden Kavität wird mit dem Wachstum in den positiven Kontrollkavitäten verglichen.

Abbildung 1: VITEK® 2 AST-Karte
Zum Vergrößern hier klicken
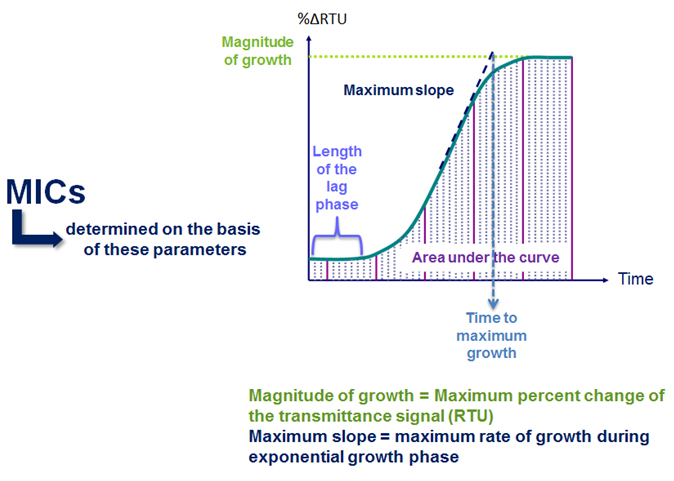
Abbildung 2: Prinzip der VITEK® 2 MHK-Bestimmung
Zum Vergrößern hier klicken
Wie wird die MHK bestimmt?
Der MHK-Wert wird bestimmt, indem das Wachstum des Patientenisolats mit dem Wachstum von Isolaten mit bekanntem MHK-Wert verglichen wird. Dieser Prozess ist vergleichbar mit einer Standardkurve, die im VITEK® 2 gespeichert ist, wobei die Standardkurve MHK-Referenzwerte entsprechend der Wachstumseigenschaften in den Antibiotika enthaltenden Wells zuordnet.
Hervorzuheben ist, dass die “Standardkurven” in VITEK® 2:
- multidimensional sind, da VITEK® 2 kontinuierlich mehrere Parameter betrachtet (im Gegensatz zur Ablesung von Endpunkten nach Inkubation über Nacht),
- mit Hilfe von mehr als 1.800 gramnegativen und über 1.200 grampositiven Organismen mit verschiedensten Resistenzmechanismen erstellt wurden.
Da VITEK® 2 das Wachstum zeitlich kontinuierlich erfasst und mehrere Parameter zur Prüfung verwendet (im Gegensatz zu einem einzelnen Endpunkt nach Inkubation über Nacht), ist es nicht zwingend notwendig, ein Well für jede einzelne MHK zu haben. Ein einzelnes Well ist unter Umständen ausreichend, um Informationen für mehr als eine MHK bereitzustellen.
Das ist der Fall, weil die Keimaktivität in einem Well mittels einer Skala interpretiert werden kann, die aussagekräftiger ist als lediglich Wachstum bzw. kein Wachstum.
Was bedeutet eine kontinuierliche Messung?
Um die Bedeutung einer kontinuierlichen Messung der Organismenaktivität zu veranschaulichen, schauen wir uns einen VITEK® 2 AST-Test an, der MHK-Werte für einen Konzentrationsbereich von ≤ 0,25 μg/ml bis > 4 μg/ml liefert. Die Diagramme 1 bis 6 veranschaulichen das Verhältnis zwischen den von einem VITEK® 2-System ermittelten Daten und den Ergebnissen, die eine Referenzmethode liefert.
Jeder Graph zeigt das Wachstum, wie es vom VITEK® 2-System für einen bestimmten Keim mit verschiedenen Referenz-MHKs beobachtet wird.
Beim Interpretieren der Kurven fällt sofort auf, dass wir die Wachstumsaktivität bei den verschiedenen Konzentrationen von Antibiotika viel effektiver auswerten können, als nur durch die Angabe Wachstum bzw. kein Wachstum.
Mit nur drei Konzentrationen kann der VITEK® 2 sechs spezifische Wachstumsmuster erkennen, die es dem Gerät ermöglichen, sechs verschiedene MHK zu melden.
Eine weitere wesentliche Funktion der VITEK® 2-Analyse besteht in der Standardisierung der Daten für einen Testkeim, wobei das Wachstum in den Wells mit antimikrobiellem Wirkstoff mit dem Wachstum in der Kontrollkavität verglichen wird.
Dieser Schritt ist wesentlich, um das relative Keimwachstum zu bestimmen, da die Form der Wachstumskurven für verschiedene Keimarten unterschiedlich ist.
Die Länge der Verzögerungsphase, die Steigungs- sowie die Beschleunigungsraten während der exponentiellen Phase verleihen einem Keim eine spezifische Wachstumscharakteristik.
Um den Prozess der Datenstandardisierung besser zu verstehen, betrachten wir z.B. im Diagramm 2 das Wachstum in der 0,5 μg/ml-Kavität im Vergleich zum Wachstum in der Kontrollkavität. Dieser Keim hat eine Referenz-MHK von 0,5 µg/ml. Das Wachstum in der 0,5 μg/ml-Kavität beträgt ca. 60% des Wachstums in der Kontrollkavität. Im Diagramm 3 allerdings hat der Keim eine Referenz-MHK von 1 µg/ml und die Aktivität in dem Well mit einer Konzentration von 0,5 μg/ml beträgt 95% gegenüber der Aktivität im Well, das nur Medium enthält. Diese Prozentsätze bzw. relativen Keimwachstumswerte werden vom VITEK® 2 zur Bestimmung präziser MHK verwendet.
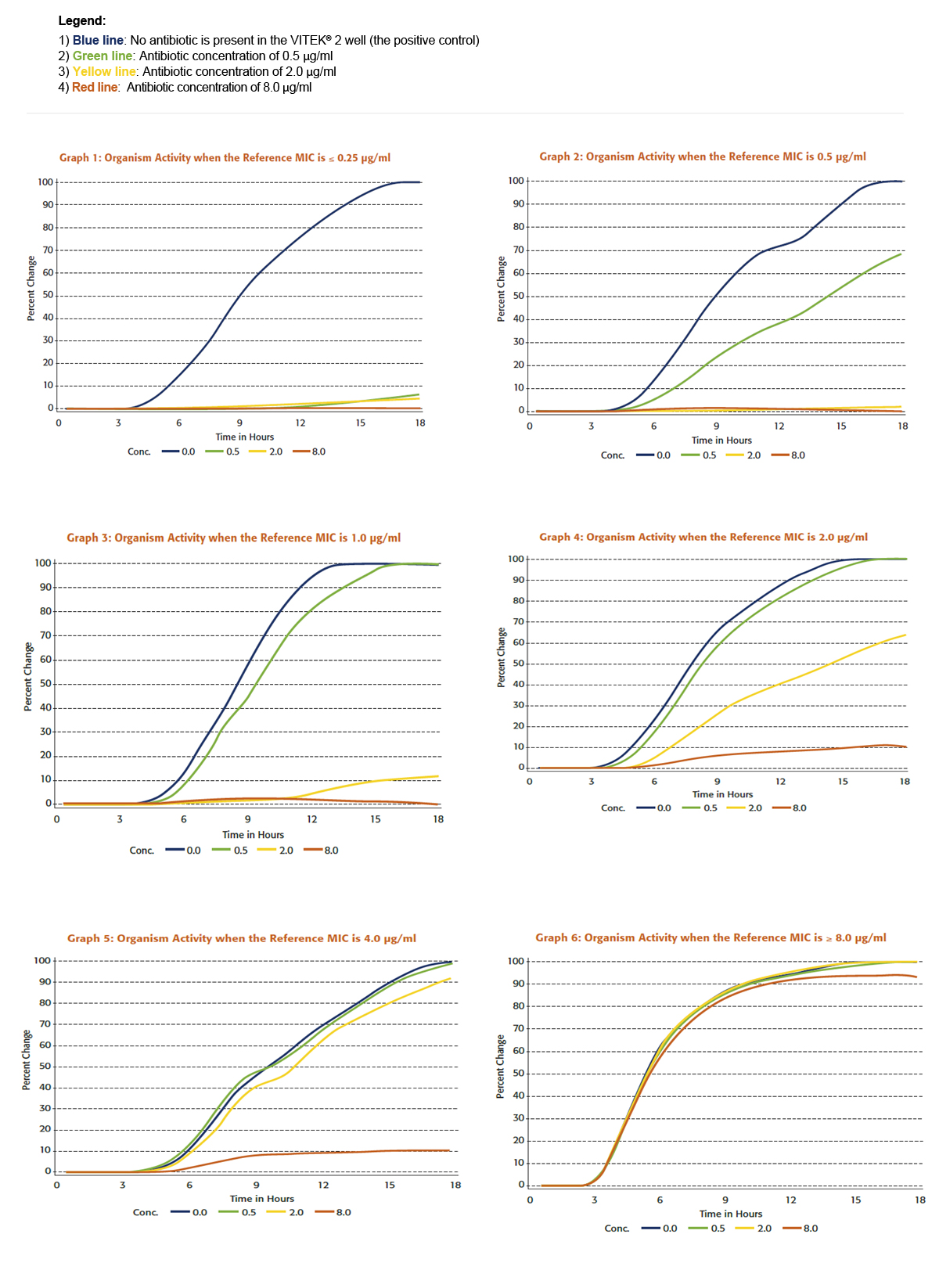
Diagramme 1-6
Zum Vergrößern hier klicken
Die nachfolgende Tabelle 1 fasst die VITEK® 2-Analyse des relativen Keimwachstums für die Daten in den Diagrammen 1 bis 6 zusammen.
Sie zeigt das Verhältnis der MHK zwischen dem durch das VITEK® 2 ermittelten Keimwachstum und der Referenzmethode.
| Keim/Diagramm |
Referenz-MHK |
Wirkstoff-Konzentration | ||
| 0.5 | 2.0 | 8.0 | ||
| 1 | ≤ 0.25 | 3% | 2% | 1% |
| 2 | 0.5 | 60% | 3% | 1% |
| 3 | 1.0 | 90% | 8% | 2% |
| 4 | 2.0 | 95% | 50% | 8% |
| 5 | 4.0 | 99% | 92% | 9% |
| 6 | ≥ 8.0 | 100% | 100% | 99% |
Tabelle 1: Relatives Keimwachstum in Prozent in einer Kavität mit antimikrobiellem Wirkstoff im Vergleich zum Wachstum in der Kontrollkavität
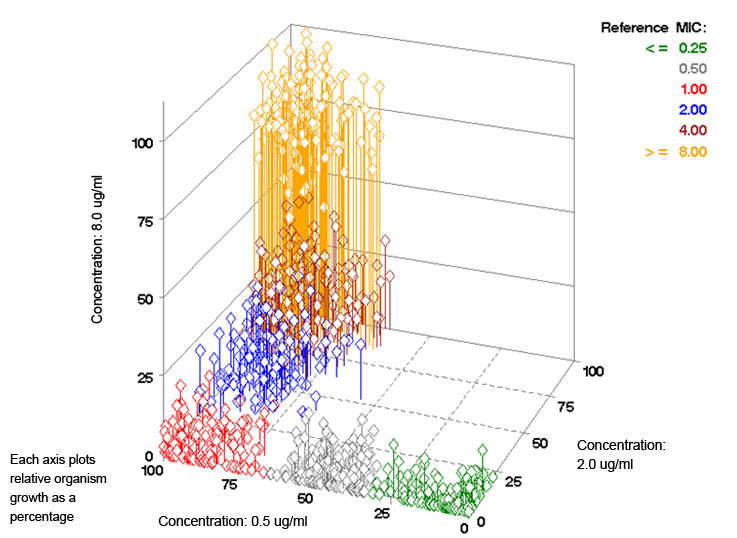
- Jede Dimension repräsentiert das relative Bakterienwachstum einer spezifischen Konzentration des antimikrobiellen Wirkstoffes
- Jede Raute stellt den Punkt dar, der den drei relativen Wachstumswerten für einen bestimmten Keim entspricht.
- Die verschiedenen Farbcluster repräsentieren eine Keimgruppe mit Referenz-MHK-Werten im Bereich von ≤ 0,25 μg/ml bis > 4,0 μg/ml.
Plot 1: Relatives Keimwachstum für eine größere Anzahl von Keimen. Jede Raute stellt einen einzelnen Keim dar.
Beispielsweise wäre die Raute, die den Daten der Tabelle 1/Diagramm 3 entspricht an dem Punkt (90%, 8%, 2%).
Die 90% würden auf der Achse mit 0,5 μg/ml, die 8% auf der Achse mit 2,0 μg/ml und die 2% auf der Achse mit 8,0 μg/ml aufgetragen werden.
Da dieser Keim eine MHK von 1,0 μg/ml hat, wäre die Farbe der Raute rot (basierend auf dem MHK-Farbschlüssel im Plot 1 oben rechts).
Insgesamt zeigt die dreidimensionale Darstellung die einzigartige Fähigkeit des VITEK® 2-Systems zwischen sechs verschiedenen MHK-Werten mit nur drei Antibiotikakonzentrationen zu unterscheiden.
Außerdem sehen wir, wie die Bestimmung des relativen Keimwachstums dem VITEK® 2-System ermöglicht, spezifische Wachstumscharakteristika für jeden Keim zu erfassen, um die MHK zu bestimmen.
Die kontinuierliche Messung der Keimaktivität hilft sowohl bei der Bestimmung der MHK als auch bei der Festlegung der Inkubationszeit, die ein Organismus im VITEK® 2-System benötigt.
Mit der Kenntnis, wann ein Organismus von der Lag-Phase in die exponentielle Phase übergeht, kann die Analysesoftware die geeignete Inkubationszeit anhand des angezeigten Wachstums bestimmen:
- Am Ende der Lag-Phase in der Wachstumskontrollkavität wartet das VITEK® 2 System für eine vorgegebene Zeitdauer.
- Dann prüft VITEK® 2, ob im Well mit der niedrigsten Antibiotikakonzentration Wachstum aufgetreten ist.
- Wird während dieser Zeitspanne Wachstum beobachtet, verlängert VITEK® 2 die Inkubation für eine weitere vorgegebene Zeitdauer, um das Wachstum in den verbleibenden Wells mit den weiteren Konzentrationen zu bestimmen.
- Dieser Prozess der Verlängerung wird fortgesetzt, bis:
- kein weiteres signifikantes Wachstum mehr stattfindet, oder
- bis bei der höchsten Konzentration Wachstum gemessen wird.
Diese Verfahrensweise ermöglicht VITEK® 2 für die meisten Organismen eine relativ kurze Inkubationsdauer, da letztlich der Organismus die Inkubationsdauer bestimmt. Das Gerät passt sich einfach an, wenn Wachstum erkannt wird. Dies hat den zusätzlichen Vorteil, dass der Nachweis von Resistenzmechanismen mit einer verzögerten Ausprägung ermöglicht wird.
Fazit
Das VITEK® 2-Verfahren zur Bestimmung der minimalen Hemmkonzentration geht über traditionelle Methoden hinaus – aber Traditionen zu pflegen, ist nicht das Ziel der Wissenschaft. Im Gegenteil, wir müssen immer nach effizienteren, effektiveren und genaueren Methoden forschen, um Neues zu erreichen.
Die Fähigkeit des VITEK®2-Systems zur kontinuierlichen Messung der Keimaktivität zur Feststellung der genauen Inkubationsdauer und Bestimmung der MHK macht das System schneller als herkömmliche Methoden. Während der Evaluierung klinischer Studien wurde wiederholt gezeigt, dass dieses Verfahren genaue und reproduzierbare Ergebnisse liefert.