Au fil des années, on m’a souvent demandé si les CMI fournies par VITEK® 2 étaient « réelles » ou « vraies ». Pour répondre à cette question, je dirais que vous devez d’abord vous demander ce qu’est une vraie CMI, autrement dit une vraie concentration minimale inhibitrice.
- C’est la méthode de référence.
- Elle peut être lue manuellement.
- Une incubation pendant la nuit est nécessaire.
- Elle n’implique aucun calcul de résultats.
- Il existe un puits pour chaque CMI rapportée.
- Il y a un grand nombre de CMI testées en double dilution géométrique de raison 2.
- Les organismes de type sauvage peuvent être différenciés des organismes de type non sauvage.
Intéressons-nous donc à ces différentes définitions d’une « réelle » ou d’une « vraie » CMI.
Est-ce la méthode de référence ?
Si cela était le cas, la grande majorité des systèmes de diagnostic in vitro (DIV) ne seraient pas classés comme étant des systèmes de CMI « réelle » ou « vraie ». Seules les méthodes qui respectent scrupuleusement la norme 20776-1:2006 (E)1 de l’Organisation internationale de normalisation (ISO) ou la norme M07-A102 du Clinical and Laboratory Standards Institute (CLSI) seraient classées comme délivrant des CMI « réelles » ou « vraies ». Les fabricants de DIV qui fournissent des panels de CMI de référence sont très peu nombreux. Ces panels doivent être congelés conformément aux normes ISO et CLSI. Les panels déshydratés, par exemple, ne peuvent être pas considérés comme équivalents à la méthode de référence. Cette définition est donc très restrictive.
Cela signifie-t-il simplement qu’elle peut être lue manuellement, qu’une incubation pendant la nuit est nécessaire et/ou qu’elle n’implique aucun calcul de résultats ?
Les systèmes de diagnostic in vitro qui peuvent être lus manuellement, qui demandent une incubation pendant la nuit et/ou qui n’impliquent aucun calcul de résultats délivrent-ils vraiment des CMI qui sont plus « réelles » ou « vraies » que les systèmes qui ne présentent pas ces caractéristiques ? Les dispositifs pour antibiogrammes (tests de sensibilité aux antimicrobiens) doivent démontrer une performance équivalente à celle de la méthode de référence sans pour autant utiliser eux-mêmes cette méthode de référence. Tenez compte du fait que tous les systèmes qui ne constituent pas la méthode de référence doivent faire l’objet d’essais cliniques (c.-à-d. d’études de performance) pour démontrer qu’ils équivalent à la méthode de référence afin d’être autorisés par la FDA américaine (United States Food and Drug Administration) ou d’obtenir le marquage CE. Cela comprend les microplaques de 96 puits traditionnels au format panel déshydraté. Dans ces cas, quelle que soit la façon dont les résultats de la CMI sont obtenus, la performance des essais cliniques que l’on retrouve sur l’étiquette du produit du fabricant est le véritable indicateur de la performance de ces systèmes par rapport à la méthode de référence qui est la règle d’or. La FDA et l’ISO ont des critères de performance similaires et très stricts que les systèmes d’antibiogrammes/de diagnostic in vitro doivent respecter pour être autorisés ou enregistrés, quelle que soit la méthodologie utilisée.
- Concordances essentielles en CMI > 90 % (EA, c’est-à-dire la concordance en pourcentage où la valeur de CMI de la méthode du test est corrélée à plus ou moins une double dilution à la valeur de CMI établie avec la méthode de référence).
- Concordances en catégories > 90 % (c’est-à-dire la concordance en pourcentage où l’interprétation sensible (S), intermédiaire (I) ou résistante (R) de la CMI pour la méthode de test concorde avec l’interprétation S, I ou R de la méthode de référence).
- Erreurs majeures < 3,0 % basées uniquement sur les isolats sensibles (les erreurs majeures sont les isolats rendus S par la méthode de référence et R par la méthode de test).
- La FDA et l’ISO ont des taux d’erreur très majeure (VME) acceptables. (Les VME sont des isolats qui testent R par la méthode de référence et S par la méthode de test.)
- Les critères réglementaires de la FDA exigent un taux d’erreur très majeure basé sur des isolats résistants seulement avec des critères statistiques d’acceptation proposés qui incluent une limite supérieure et inférieure de l’intervalle de confiance à 95 % pour le taux d’erreur très majeure réel de < 7,5 % et < 1,5 %, respectivement.
- L’ISO exige des taux d’erreur très majeure ≤ 3,0 % basés sur des isolats résistants seulement.
VITEK® 2 est homologué par l’US FDA et porte le marquage CE, et doit de ce fait prouver que ses CMI sont corrélées avec celles de la méthode de référence. Même si les résultats de VITEK® 2 AST ne peuvent pas être lus manuellement, qu’ils ne nécessitent pas d’incubation pendant la nuit et qu’ils donnent des CMI calculées, les résultats sont corrélés à la méthode de référence, comme indiqué par le marquage CE de tous les antibiotiques cliniques humains proposés avec VITEK® 2 et l’approbation de la FDA pour la plupart d’entre eux. Encore un autre point important : la lecture manuelle des CMI peut être chronophage et très subjective. Les résultats de VITEK® 2 AST concordent non seulement avec la méthode de référence, mais ils offrent aussi l’avantage d’être objectifs, reproductibles et rapides. En effet, les résultats de VITEK® 2 peuvent être considérés comme plus normalisés que les systèmes permettant la lecture manuelle des résultats, car la lecture automatisée élimine toute subjectivité dans l’interprétation des résultats : les résultats d’un même isolat sont interprétés de la même façon, indépendamment des erreurs visuelles liées à la personne qui lit le test.
Donc, pour que l’on puisse parler de CMI « réelle » ou « vraie », est-ce qu’il est important d’avoir un puits rapporté pour chaque CMI, un grand nombre de dilutions doubles, et/ou une différenciation entre les organismes de type sauvage et non sauvages ?
Tout d’abord quelques mots sur les doubles dilutions. Ce n’est pas parce qu’un système présente physiquement des doubles dilutions que cela en fait la méthode de référence. Par exemple, les systèmes rapides et automatisés ne respectent manifestement pas les conditions d’essai de la méthode de référence puisque celle-ci exige une incubation de 16 à 24 heures, selon la combinaison organisme/antimicrobien. Pourtant, avec les données de performance des essais cliniques, une équivalence avec la méthode de référence est établie pour ces systèmes.
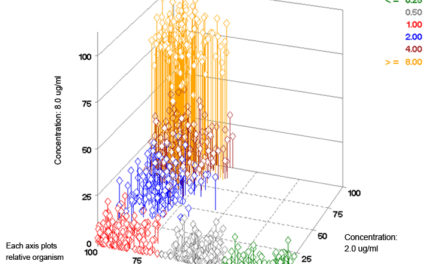
Une plage de CMI très large est souhaitable mais souvent peu pratique pour la grande variété d’antibiotiques qui doivent être testés sur chaque isolat. Comme les taux de résistance augmentent, nous devons tester plus d’antibiotiques, mais la capacité des dispositifs jetables pour antibiogrammes est limitée. De nombreux dispositifs pour antibiogrammes n’ont finalement utilisé que les concentrations nécessaires pour fournir une interprétation de catégorie pour la majorité des antibiotiques disponibles sur leurs panels. VITEK® 2 rapporte une plage de CMI de sept doubles dilutions pour la plupart des antibiotiques, couvrant souvent la valeur de seuil épidémiologique utilisée pour différencier les souches de type sauvage des souches de type non sauvage. Il s’agit là de l’une des plages de CMI couvertes les plus larges par rapport à des systèmes d’identification et d’antibiogramme rapides et automatisés similaires. L’ISO et la FDA ont établi des critères pour un test ou un système de CMI que satisfont la plupart des antibiotiques sur VITEK® 2 :
- Selon la norme ISO 20776-24, un essai de CMI est un « essai capable de déterminer une valeur de CMI couvrant au moins cinq doubles dilutions, et pour lequel la concordance essentielle peut être déterminée ».
- Le document « Class II Special Controls Guidance Document »3, publié par la FDA en 2009, définit les systèmes de CMI comme suit : « Dilution en bouillon, dilution en gélose ou autres méthodes ou systèmes qui ont au moins cinq concentrations de raison géométrique 2 d’antibiotiques », avec des spécificités supplémentaires clairement respectées par VITEK® 2, étant donné que la grande majorité des antibiotiques du système ont reçu l’autorisation de la FDA pour fournir des résultats de CMI quantitatifs, plutôt que des résultats de catégorie qualitatifs (SIR).
- La FDA définit également les systèmes de concentrations critiques systèmes : « La conception des systèmes est similaire à celle des systèmes de CMI, mais avec quatre concentrations ou moins de chaque antibiotique. Ces concentrations sont les seuils d’interprétation (basés sur les valeurs de CMI permettant leur interprétation en catégories de la FDA pour chaque antibiotique) qui fournissent un résultat qualitatif (catégorie). La FDA considère ces dispositifs comme étant qualitatifs.»3
Que devons-nous alors en conclure dans le cadre de notre examen d’une « vraie » CMI ?
C’est sans doute la norme M07-A102 du CLSI qui définit le mieux une « vraie » CMI : « La « vraie » CMI se situe entre la plus faible concentration d’antibiotique qui inhibe la croissance de l’organisme (c.-à-d. la lecture de la CMI) et la plus faible concentration d’antibiotique et la plus faible suivante. Si, par exemple, des doubles dilutions ont été utilisées et que la CMI est de 16 µg/mL, la « vraie » CMI est comprise entre 16 µg/mL et 8 µg/mL. » Si cette définition est utilisée, aucun dispositif pour antibiogramme, y compris la méthode de référence, ne fournit alors de « réelles » ou de « vraies » CMI. En fin de compte, ce qui importe avant tout, c’est que les CMI soient précises !
Que faut-il retenir sur les CMI et VITEK® 2 ?
La prochaine fois que vous voudrez savoir si les CMI de votre système AST sont « réelles », retenez simplement que pour le marquage CE ou l’approbation de la FDA, l’important est que le test puisse montrer des performances équivalentes à la méthode de référence, comme en témoignent les données de performance de l’essai clinique accompagnant le dispositif. Cet ensemble de données, exigé par la loi, est généré par chaque fabricant de systèmes de CMI sans méthode de référence afin d’établir l’équivalence avec la méthode de référence. C’est encore mieux lorsque le dispositif pour antibiogrammes fournit des CMI précises, reproductibles et rapides tout en ayant un impact positif sur le flux de travail du laboratoire, comme VITEK® 2.
Références
-
ISO. Clinical laboratory testing and in vitro diagnostic test systems – Susceptibility test of infectious agents and evaluation of performance of antimicrobial susceptibility test devices –Part 1: Reference method for testing the in vitro activity of antimicrobial agents against rapidly growing aerobic bacteria involved in infectious diseases-First Edition. ISO document 20776-1. Switzerland: ISO; 2006.
-
CLSI. Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically; Approved Standards, 10th Ed. CLSI document M07-A10. Wayne, PA: Clinical and Laboratory Standards Institute; 2015.
-
U.S. Department of Health and Human Services, Food and Drug Administration, Center for Devices and Radiological Health. Class II Special Controls Guidance Document: Antimicrobial Susceptibility Test (AST) Systems. http://www.fda.gov/MedicalDevices/DeviceRegulationandGuidance/GuidanceDocuments/ucm080564.htm. U.S. Department of Health and Human Services; 2009.
-
ISO. Clinical laboratory testing and in vitro diagnostic test systems – Susceptibility test of infectious agents and evaluation of performance of antimicrobial susceptibility test devices – Part 2: Evaluation of performance of antimicrobial susceptibility test devices-First Edition. ISO document 20776-1. Switzerland: ISO; 2007.
Acronymes:
-
S: Susceptible
-
I: Intermediate
-
R: Resistant